- Описание
- Область применения
- Результаты применения (галерея)
- Протокол использования
- Механизм контрастирования
- Процесс контрастирования (видео)
- Список публикаций
- Дополнительная информация
Описание
Набор «BioREE-B» – один из продуктов серии BioREE™ для суправитального лантаноидного контрастирования биологических объектов, которое позволяет визуализировать на сканирующем электронном микроскопе (SEM) структуру подповерхностного слоя образцов, а также элементы их внутреннего строения без предварительной фиксации / обезвоживания / напыления.
Использование набора «BioREE-B» для двухэтапного контрастирования биологических объектов позволяет не только получить высококонтрастное SEM-изображение с расширенной информацией о структуре клеток, но и сравнительно оценить их метаболическую активность и функциональный статус.
Набор «BioREE-B» также применим для изучения патогенных микроорганизмов за счет наличия в протоколе набора этапа постфиксации образца.
Область применения
Набор реактивов «BioREE-B» предназначен для подготовки биологических образцов к исследованию на сканирующем электронном микроскопе (SEM). Классифицируется как лантаноидный с дополнительным шагом контрастирования солями свинца. В ходе окрашивания выделенные из организма ткани помещают в условия, обеспечивающие протекание в них основных жизненных процессов, и насыщают целевым веществом (суправитальное воздействие), что позволяет в дальнейшем визуализировать методом SEM структуру поверхности, подповерхностного слоя, элементы внутреннего строения, а также получить информацию о сравнительном функциональном статусе клеток в образце. Сопутствующим результатом контрастирования является стабилизация естественного обезвоживания клеток, что предотвращает их деформацию и способствует сохранению их нативного состояния при исследовании.
Набор применим для изучения следующих видов биологических объектов:
Полученные при помощи реактивов набора контрастированные препараты предназначены для исследования на сканирующих электронных микроскопах (SEM), имеющих режим низкого вакуума (поддержание 55–90 Па) и детектор обратно-рассеянных электронов (BSE).
Ограничения применения. Лантаноидное контрастирование не может применяться к фиксированным тканевым блокам. Также, в связи с агрессивным замещением лантаноидами кальция в фосфатах не рекомендуется использование набора для объектов на фосфатных подложках, а также при изучении костей и зубов. Дополнительным требованием к носителю является его устойчивость к слабокислым условиям среды ввиду присутствия в наборе реактива с рН 5.
Результаты применения (галерея)
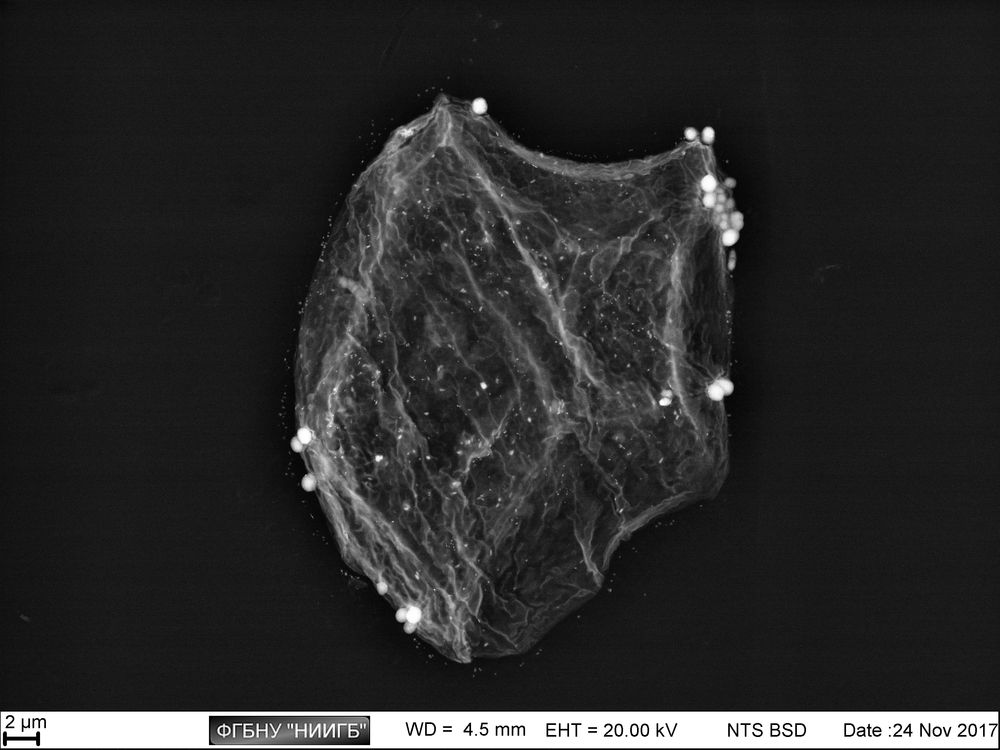
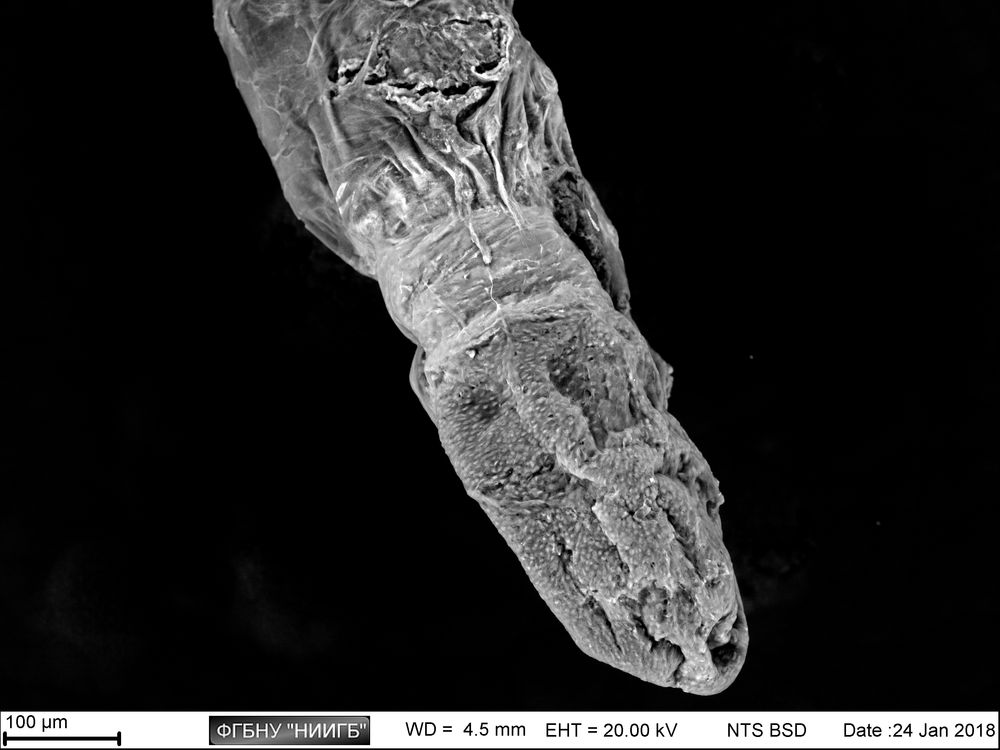
Приведенные образцы результатов исследований получены на электронном микроскопе Zeiss EVO LS10 в лаборатории фундаментальных исследований ФГБНУ «НИИГБ».
Протокол использования
Процесс контрастирования с использованием набора «BioREE-B» занимает не более 1 часа. При необходимости долговременного хранения образца и/или при работе с патогенными организмами в протоколе набора предусмотрен дополнительный этап постфиксации. Высокая информативность контрастирования обеспечивается только при использовании в качестве исследуемого объекта живых (нефиксированных) клеток.
Подготовка образцов биологического материала:
Допустимо размещение исследуемых объектов (тонких тканевых проб толщиной до 1 мм, культивируемых или первично полученных клеток и др.) на пластике любого типа, силикатном стекле, в том числе с покрытием, а также на углеродных и полимерных скаффолдах на нефосфатной основе. Также носитель образца должен быть устойчив к слабокислым условиям среды.
Последовательность проведения анализа:
- Первичная промывка образца изотоническим раствором хлорида натрия
(для удаления сорбировавшихся на поверхности образца компонентов ростовых сред и жидкостей основного вещества, содержащих фосфат-ионы, и предотвращения нежелательного связывания с ними тропных к фосфатам контрастирующих ионов лантаноида и свинца). - Помещение образца в водный изотонический раствор хлорида неодима (или др. Ln3+), экспозиция – 30 мин.
Прим.: для получения лучшего результата следует проводить контрастирование в условиях, максимально приближенным к физиологическим для данного клеточного типа. - Первая промежуточная промывка образца в дистиллированной воде
(для удаления излишков 1-го контрастирующего вещества). - Помещение образца в водный изотонический раствор ацетата свинца, экспозиция – 15 мин.
Прим.: образцы, прикрепленные к подложкам, рекомендуется погружать в раствор в перевернутом виде, не допуская при этом соприкосновения поверхности образца с дном емкости. - Вторая промежуточная промывка образца в дистиллированной воде
(для удаления излишков 2-го контрастирующего вещества). - Помещение образца в фиксирующий раствор
(при необходимости долговременного хранения образца и/или при работе с патогенными организмами). - Финальная промывка образца в дистиллированной воде
(для удаления остатков фиксирующего реагента) в течение 1–10 сек.
После осуществления контрастирования с поверхности образца удаляют избыток воды, затем размещают его на предметном столике микроскопа и проводят сканирующую электронную микроскопию в режиме низкого вакуума при ускоряющем напряжении 15–30 кВ и с использованием детектора обратно-рассеянных электронов (BSE).
Более подробную информацию о подготовке образцов, проведении анализа и визуализации полученных препаратов на SEM можно получить, обратившись к следующим документам:
- Инструкция к набору «BioREE-B» (eng / rus)
- Протокол контрастирования (rus)
- Протокол визуализации контрастированных образцов на SEM (rus)
Механизм контрастирования
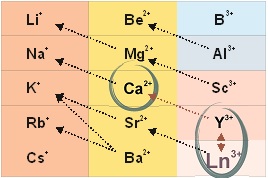
Лантоноидное контрастирование живых (нефиксированных) клеток осуществляется при использовании невысоких концентраций растворимых солей металлов этой группы (хлоридов лантана (LaCl3), неодима (NdCl3) и др.), воздействие которых не приводит к мгновенной гибели исследуемых клеток, а постепенно «выключает» в них энергозависимые процессы.
В соответствии с принципом универсального химического изоморфизма, примененного в отношении живых систем, при обработке клетки ионами лантаноида в ее структурах происходит гетеровалентное замещение ионов кальция:
3Ca2+ ↔ 2La3+,
2Ca2+ ↔ La3+ + Me+.
Вследствие этого наблюдается повышение контрастности образца при проведении SEM, в основе которого лежит не только более высокий атомный номер лантаноида по сравнению с замещаемым кальцием, но и бóльшая эффективность связывания его в неорганических и металлоорганических соединениях.
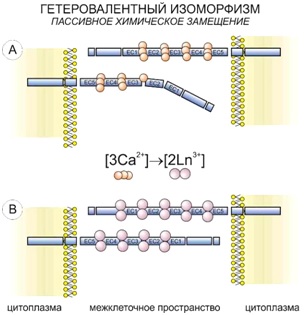
Одной из мишеней для гетеровалентного замещения являются кальциевые сочленения между пятичленными зонами белка кадгерина (компонента адгезивных контактов).
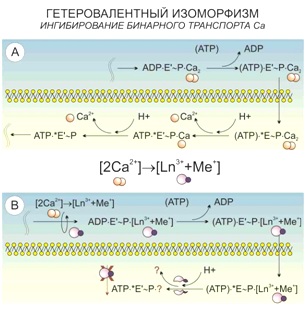
Также подобные реакции наблюдаются в участках клеточной мембраны, где располагаются кальциевые АТФазы и происходит одновременный транспорт двух ионов кальция. Данная система захватывает лантаноид в паре с щелочным металлом, и в точке деления этого канала на две ветви с независимым транспортом Ca2+ лантаноид уже не имеет возможности покинуть ее, оставаясь связанным с АТФ.
Другая мишень накопления лантаноида в клетке – зоны расположения волокон цитоскелета. Стоит отметить, что размер визуализируемых структур будет превышать реальный размер микротрубочек. Предполагается, что это – своеобразное «гало» связанных фосфат-анионов вокруг элементов цитоскелета, которые высвободились в процессе сборки микротрубочек и образуют нерастворимые соединения с ионами лантаноидов, ярко маркируя расположение микротрубочек и/или статистические направления их сборки.
Таким образом, один только первый этап контрастирования с набором «BioREE-B» позволяет повысить контрастность получаемого изображения методом SEM в режиме BSE более чем в 2 раза.
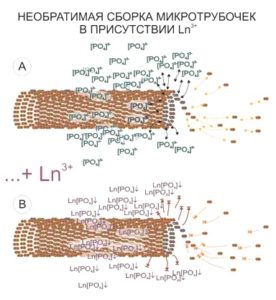
Применение же водного раствора ацетата свинца в качестве 2-го шага контрастирования протокола набора «BioREE-B» позволяет еще больше увеличить контрастность получаемых изображений в результате протекания следующих реакций:
а) реакции вытеснения свинцом лантаноида в простых фосфатах по принципу наименьшей растворимости:
3Pb2+ + 2Ln[PO4]↓ → 2Ln3+ + Pb3[PO4]2↓
при ПР(Ln[PO4]) = 3.7·10 – 23;
ПР(Pb3[PO4]2) = 7.9·10 – 43.
Стоит отметить, что на два фосфат-аниона будет приходиться три катиона свинца против двух катионов лантаноидов. Эта реакция преимущественно увеличивает яркость в обратно-рассеянных электронах элементов цитоскелета и митохондрий как объектов, пространственно связанных с большим количеством свободных фосфат-анионов. Таким образом, при «докрашивании» препарата ацетатом свинца фосфатные сайты связывания лантаноида становятся заметно контрастнее.
б) реакции взаимодействия глюкозидов с ацетатом свинца, протекающей по типу реакции Барфеда с катионами меди:
CH2OH(CHOH)4COH + Pb(CH3COO)2 + 2H2O ⇒ CH2OH(CHOH)4COOH + PbO↓ + 4CH3COOH .
Мишенью для реакций этого типа в клетках и экстрацеллюлярном матриксе будут служить глюкоза, фосфолипиды и биохимические элементы, участвующие в энергетическом обеспечении клетки, которые располагаются преимущественно в цитоплазме и эндоплазматическом ретикулуме. Контрастность этих зон повышается за счет образования оксида свинца.
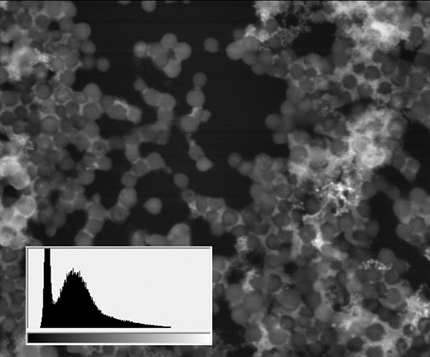
СЭМ-изображения в режиме BSE культуры Staphylococcus aureus АТСС 29213
(ширина поля зрения – 18 мкм; во врезках – гистограммы частот распределения яркости, построенные для соответствующего изображения; ускоряющее напряжение 20 кВ, низкий вакуум (70 Па), ток – 120 пА)
Таким образом, помимо основных структур, визуализацию которых обеспечивает специфическое накопление лантаноидов в клетке (ядрышек, зон межклеточных контактов, расположения в клеточных мембранах Ca-насосов и следов сборки цитоскелета), этап «докрашивания» свинцом добавляет целую группу доступных для визуализации структур, ответственных за энергетическое состояние клетки. Данный факт позволяет проводить сравнительный анализ активности метаболизма клеток разных типов в одном образце.
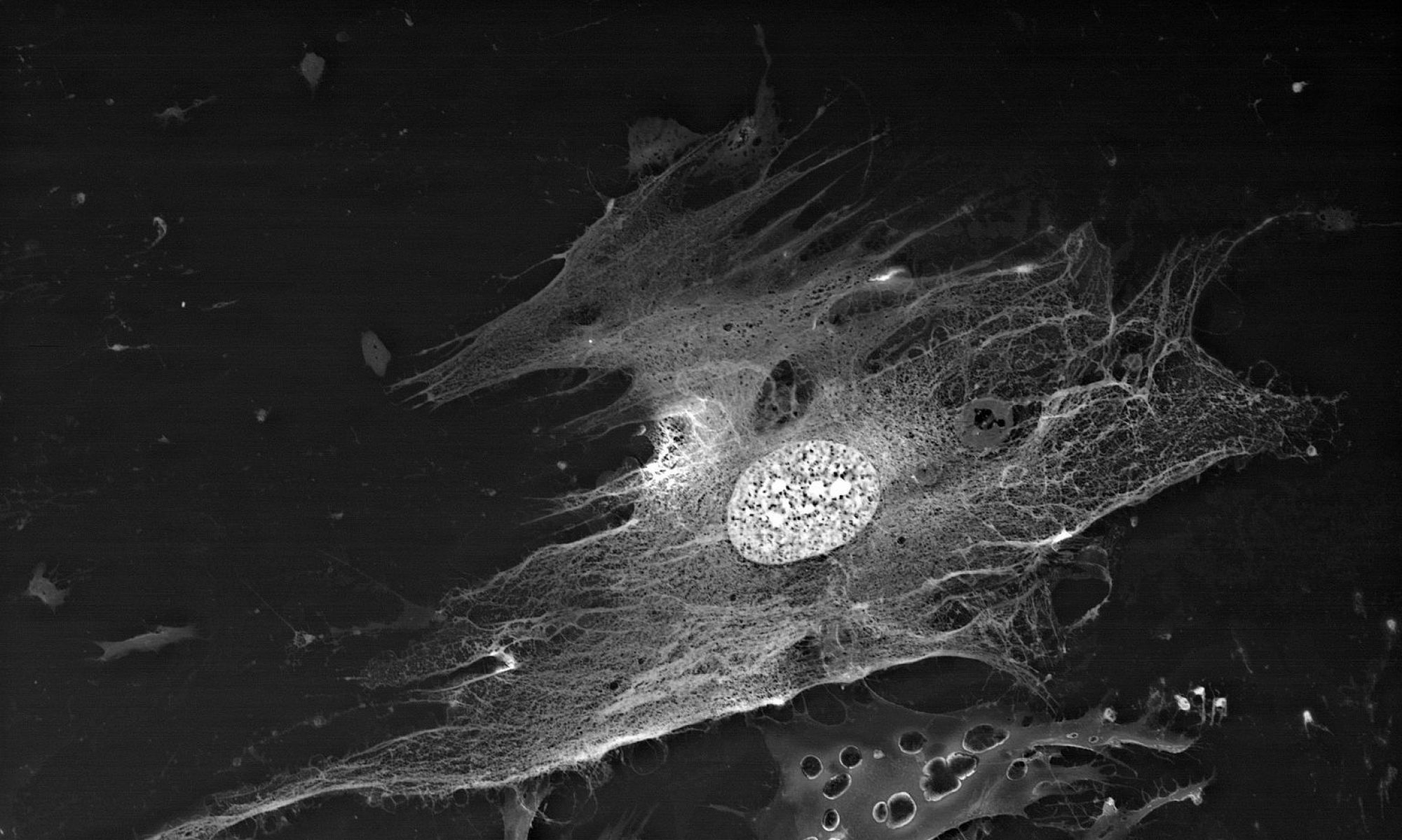
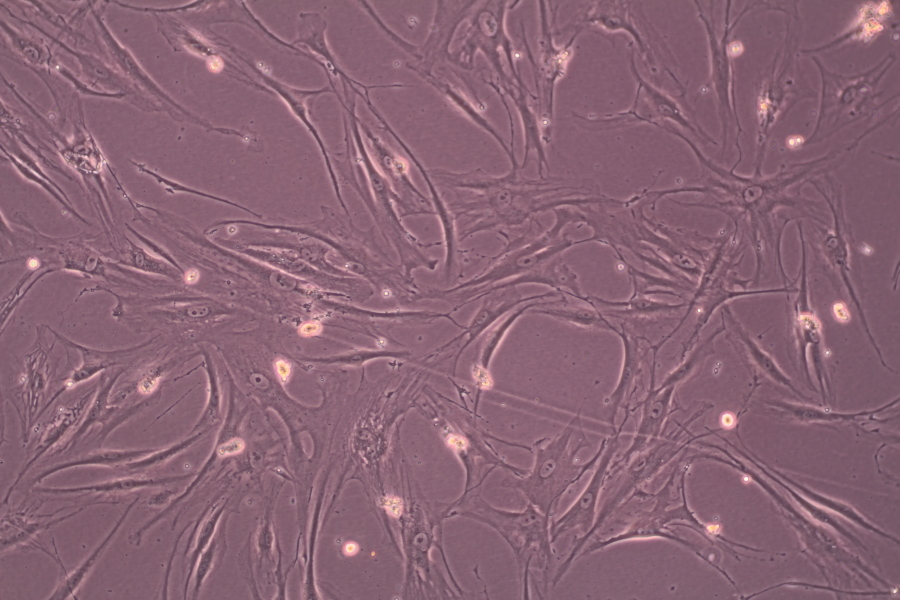
Смешанная культура клеток стромы роговицы человека и линии A549 (карциномы легких человека):
раковые клетки на изображении имеют более интенсивную окраску в связи с более высокой метаболической активностью
Процесс контрастирования (видео)
Патент RU 2672356 C1
http://www1.fips.ru/wps/PA_FipsPub/res/Doc/IZPM/RUNWC1/000/000/002/672/356/%D0%98%D0%97-02672356-00001/document.pdf
Заявка на международный патент № PCT/RU2019/000119 (от 22/02/2019)
https://patentscope.wipo.int/search/ru/detail.jsf?docId=WO2019177492&_cid=P20-K1G5WZ-12570-1
Список публикаций
- Последовательное маркирование ультраструктуры биологических объектов неодимом и свинцом в двухступенчатой схеме подготовки для сканирующей электронной микроскопии / Новиков И.А., Суббот А.М., Чеботарь И.В., Пак О.А. // Аналитика 2018, Т. 8, № 4(41), с. 358–363.
DOI: 10.22184/2227-572X.2018.41.4.358.363
http://www.j-analytics.ru/journal/article/6981 - Патент 2018108571, 12.03.2018. Способ подготовки биологического образца к исследованию при помощи сканирующей электронной микроскопии / Новиков И.А., Суббот А.М., Чеботарь И.В., Пак О.А., Бурсов А.И., Ситников А.В. // Патент России № 2672356, 2018. Бюл. № 32.
http://www1.fips.ru/wps/PA_FipsPub/res/Doc/IZPM/RUNWC1/000/000/002/672/356/%D0%98%D0%97-02672356-00001/document.pdf - Fast and easy visualization method of impression cytology probe with microbiota detection on the ocular surface / Yugay N.M., Novikov I.A., Subbot A.M., Khalatyan K.S. // 26th International Student Congress Of (bio)Medical Sciences, Groningen (Netherlands), 2019, p. 412.
https://www.researchgate.net/publication/333320273_Fast_and_easy_visualization_method_of_impression_cytology_probe_with_microbiota_detection_on_the_ocular_surface - A rapid method of whole cell sample preparation for scanning electron microscopy using neodymium chloride / Chebotar I.V., Novikov I.A., Subbot A.M., Mayansky N.A. // Micron 2019, 124. DOI: 10.1016/j.micron.2019.102687
https://www.sciencedirect.com/science/article/pii/S0968432818303111