- Описание
- Область применения
- Результаты применения (галерея)
- Протокол использования
- Механизм контрастирования
- Список публикаций
- Дополнительная информация
Описание
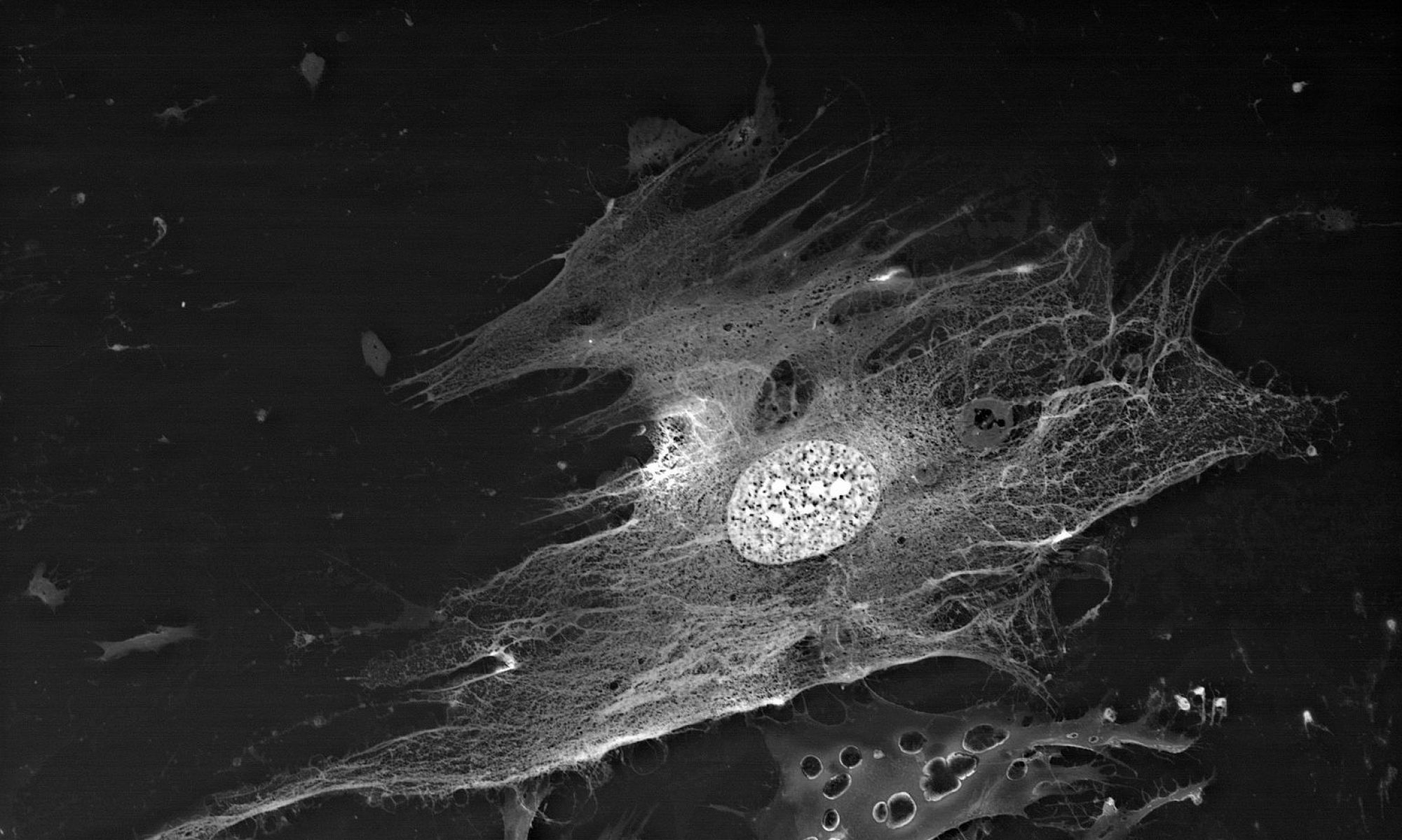
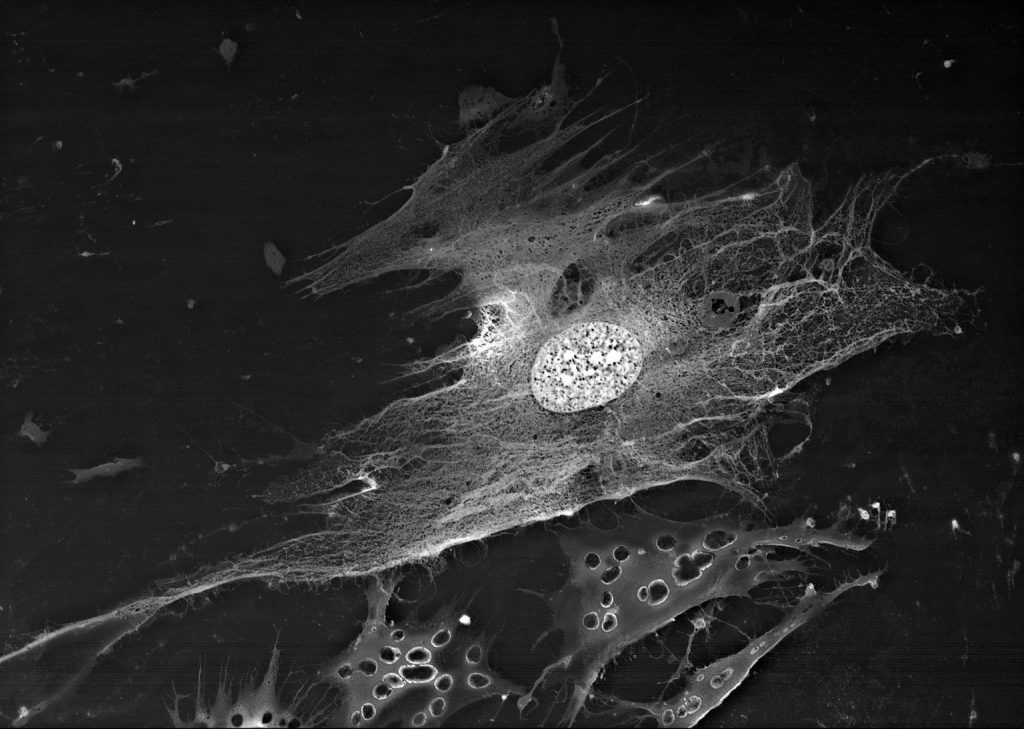
Набор «BioREE-A» – один из продуктов серии BioREE™ для осуществления лантаноидного контрастирования биологических объектов, обеспечивающих суправитальное воздействие на ткани и клетки и позволяющих визуализировать на сканирующем электронном микроскопе (SEM) структуру подповерхностного слоя биологических образцов, а также их внутреннюю структуру без предварительных фиксации / обезвоживания / напыления.
Исследование биологических объектов методом SEM с набором «BioREE-A» позволяет сохранить максимально нативное состояние исследуемого объекта при получении высококонтрастного изображения с расширенной информации о структуре клеток.
НаверхОбласть применения
Набор реактивов «BioREE-A» предназначен для подготовки биологических образцов к исследованию на сканирующем электронном микроскопе (SEM), классифицируется как лантаноидный контрастирующий, обеспечивающий насыщение тканей, выделенных из организма и помещённых в условия, обеспечивающие протекание в них основных жизненных процессов целевым веществом (суправитальное воздействие), позволяющий визуализировать методом SEM структуру поверхности, подповерхностного слоя, а также внутреннюю структуру биологического образца. Сопутствующим результатом контрастирования является стабилизация естественного обезвоживания клеток, что предотвращает их деформацию и способствует сохранению их нативного состояния при исследовании.
Набор применим для изучения следующих видов биологических объектов:
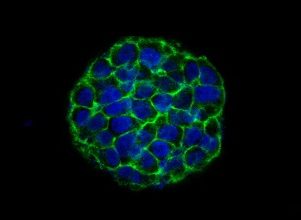
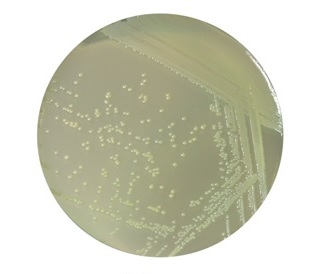
Полученные при помощи реактивов набора контрастированные препараты предназначены для исследования на сканирующих электронных микроскопах (SEM), имеющих режим низкого вакуума (поддержание 55–90 Па) и детектор обратно-рассеянных электронов (BSE).
Ограничения применения. Лантаноидное контрастирование не может применяться к фиксированным тканевым блокам. Кроме того, в связи с агрессивным замещением лантаноидами кальция в фосфатах, не рекомендуется использование набора для объектов на фосфатных подложках, а также при изучении костей и зубов.
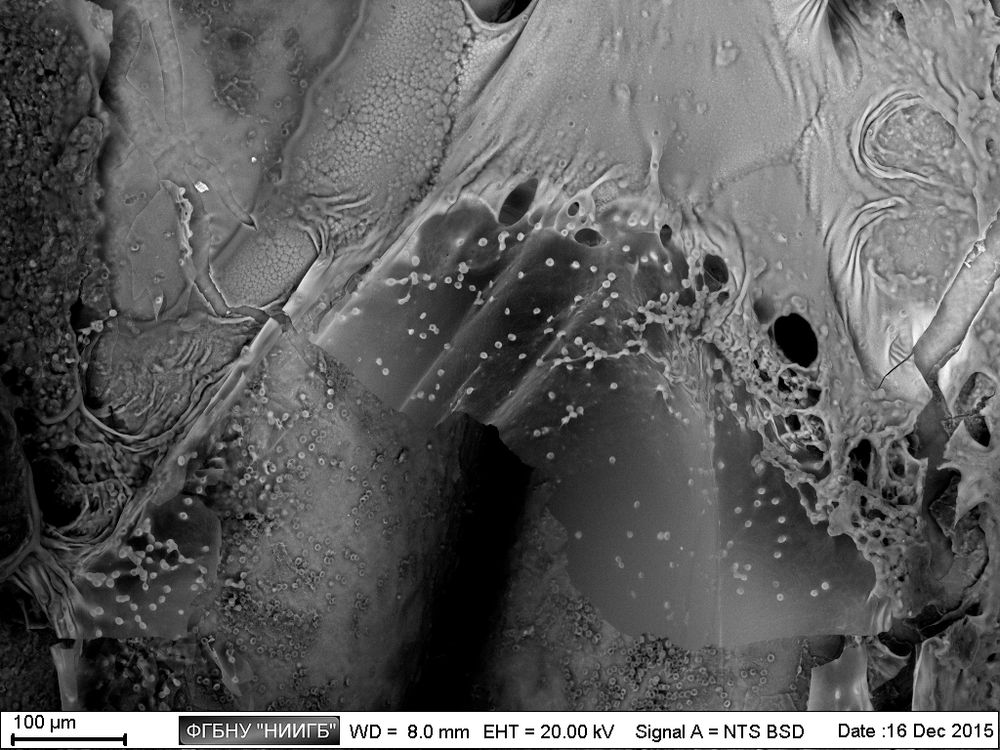
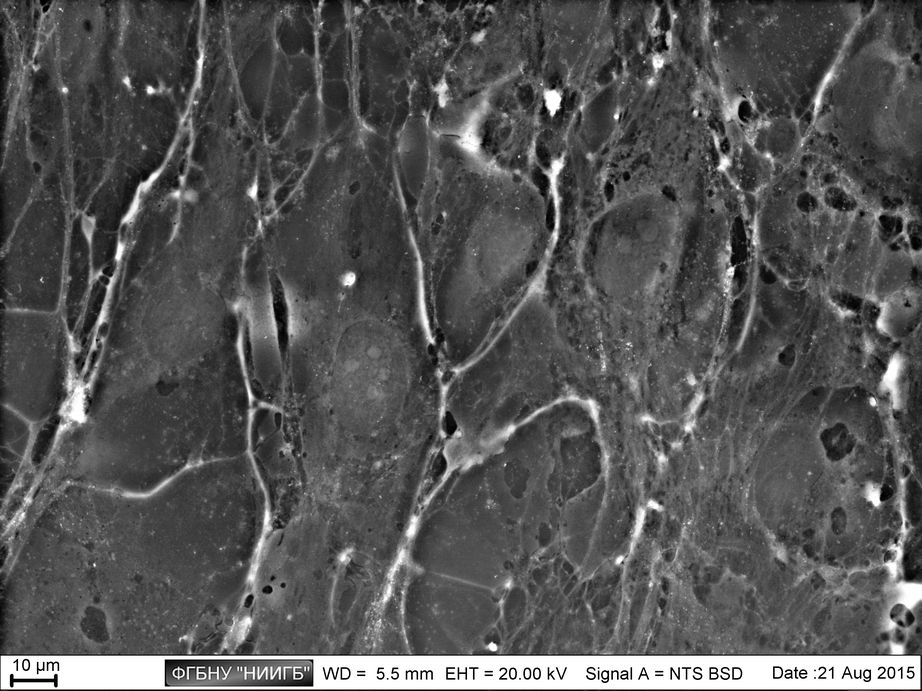
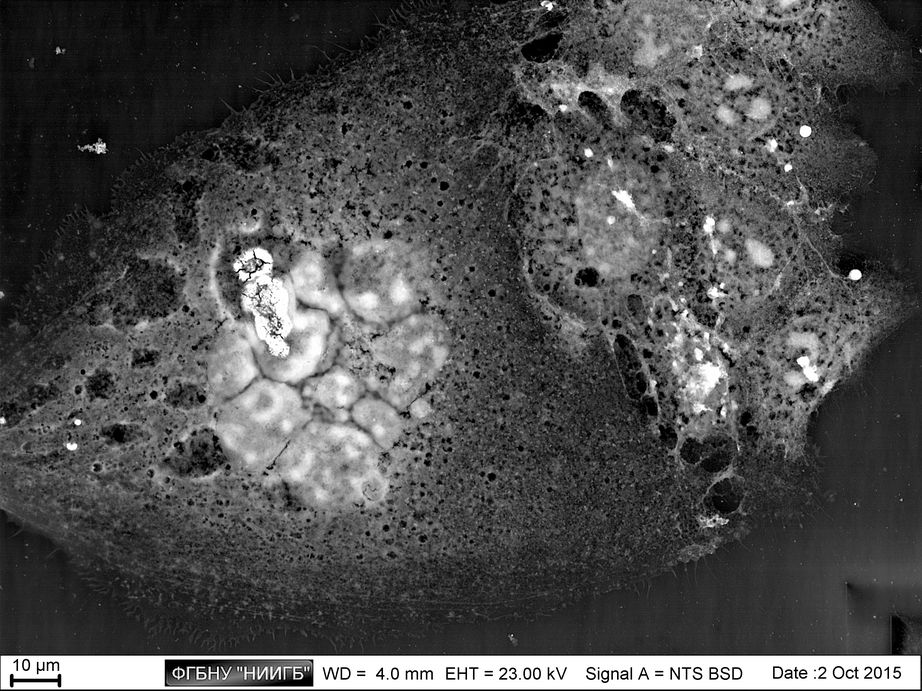
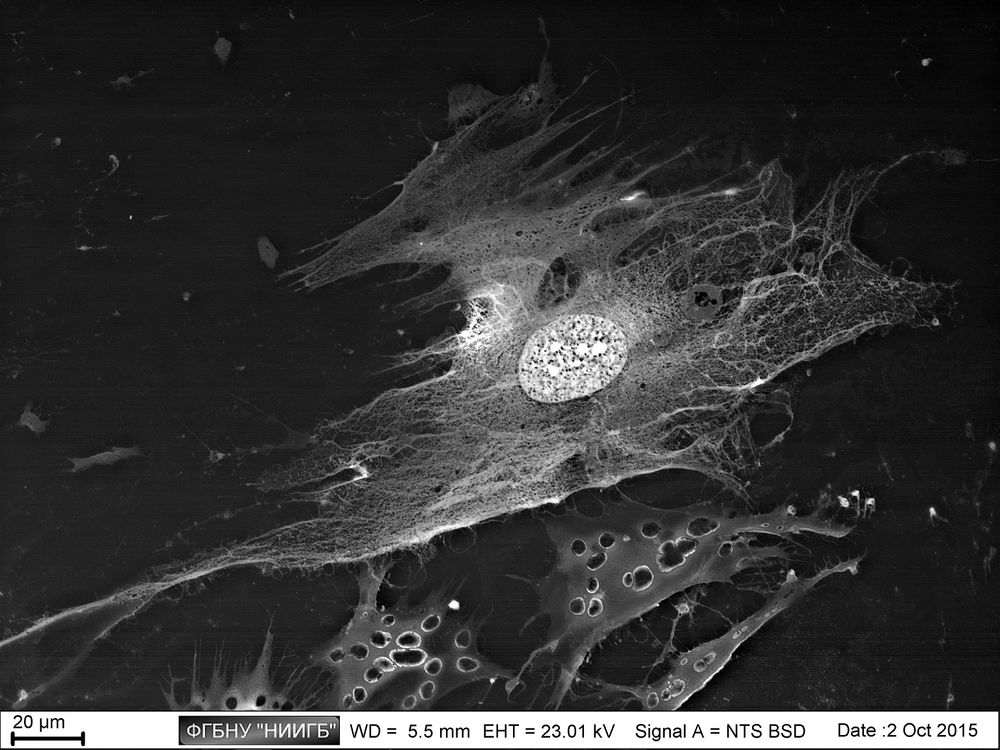
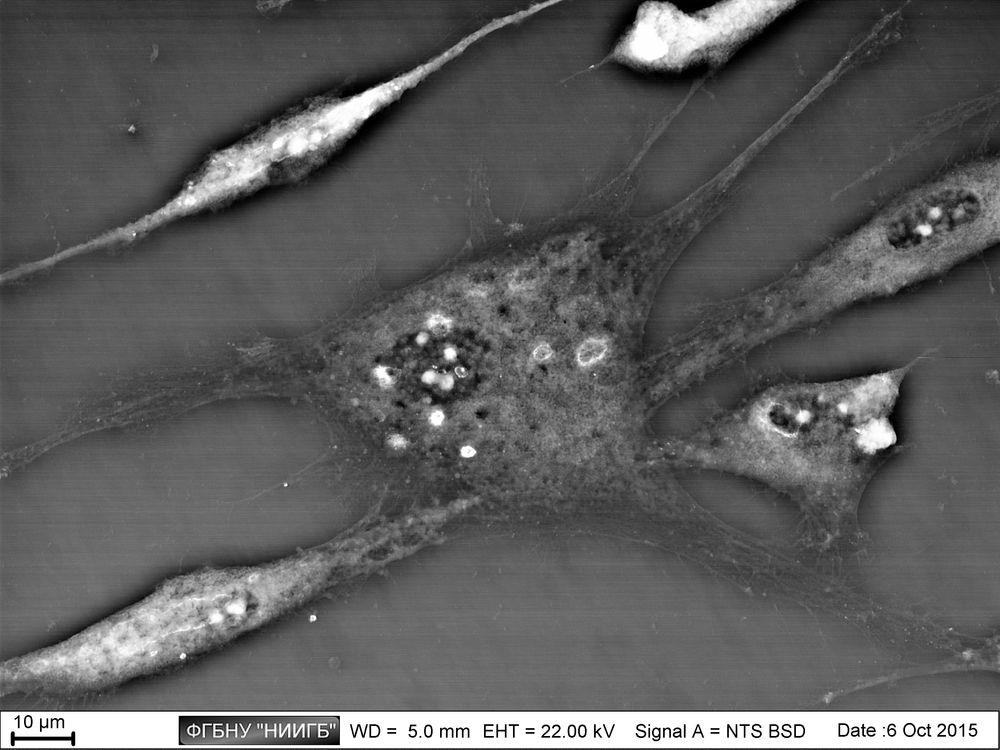
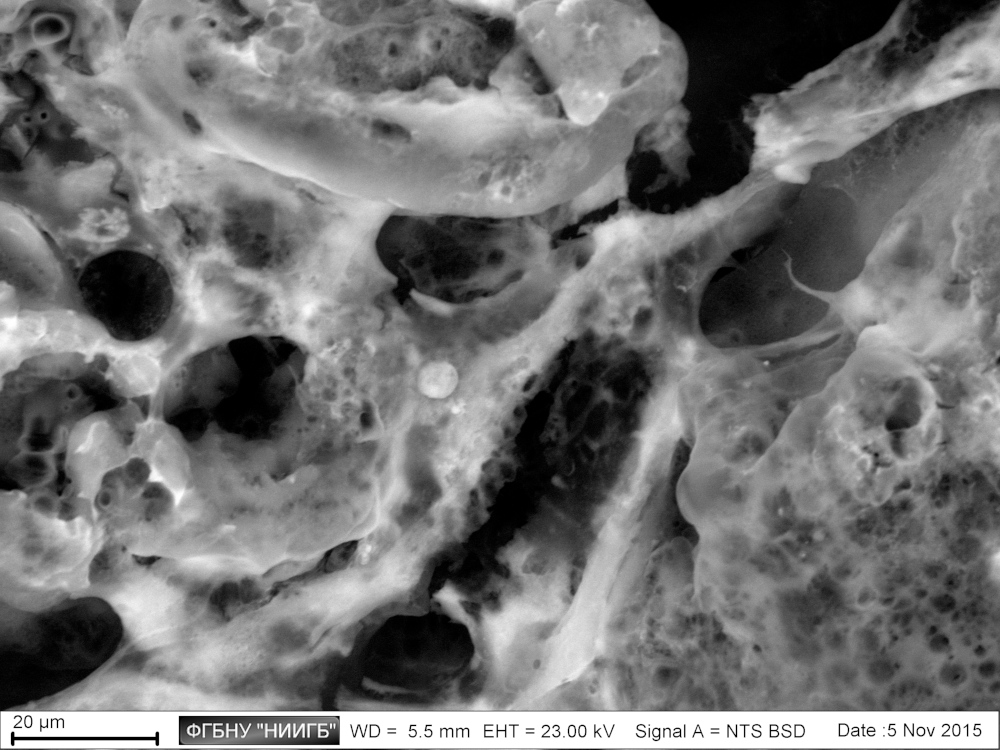
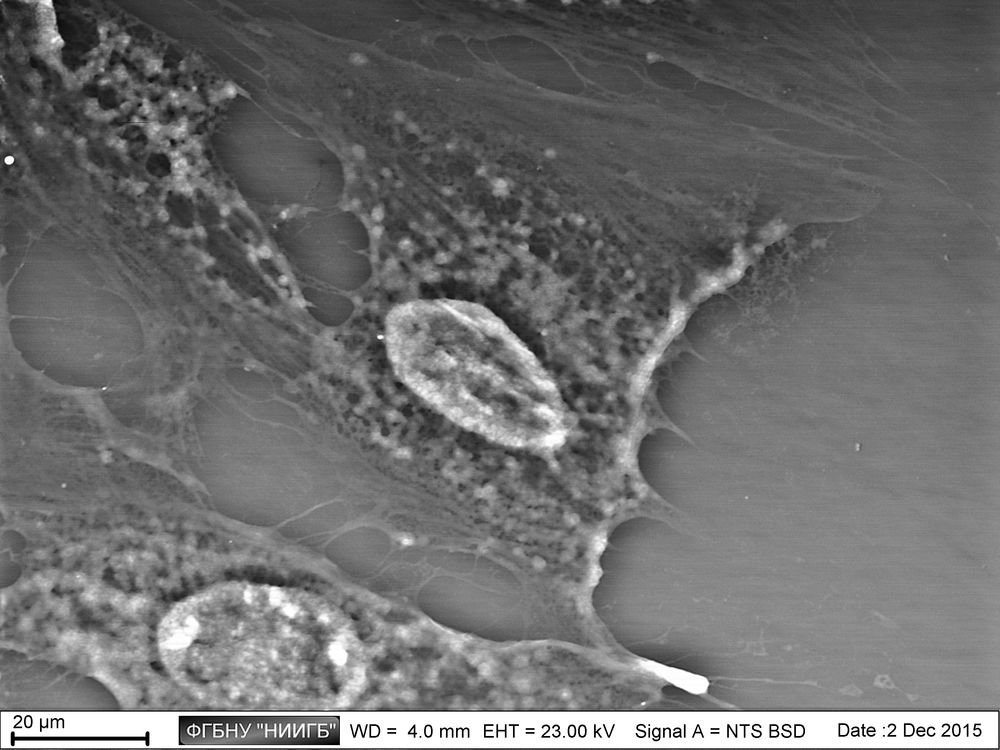
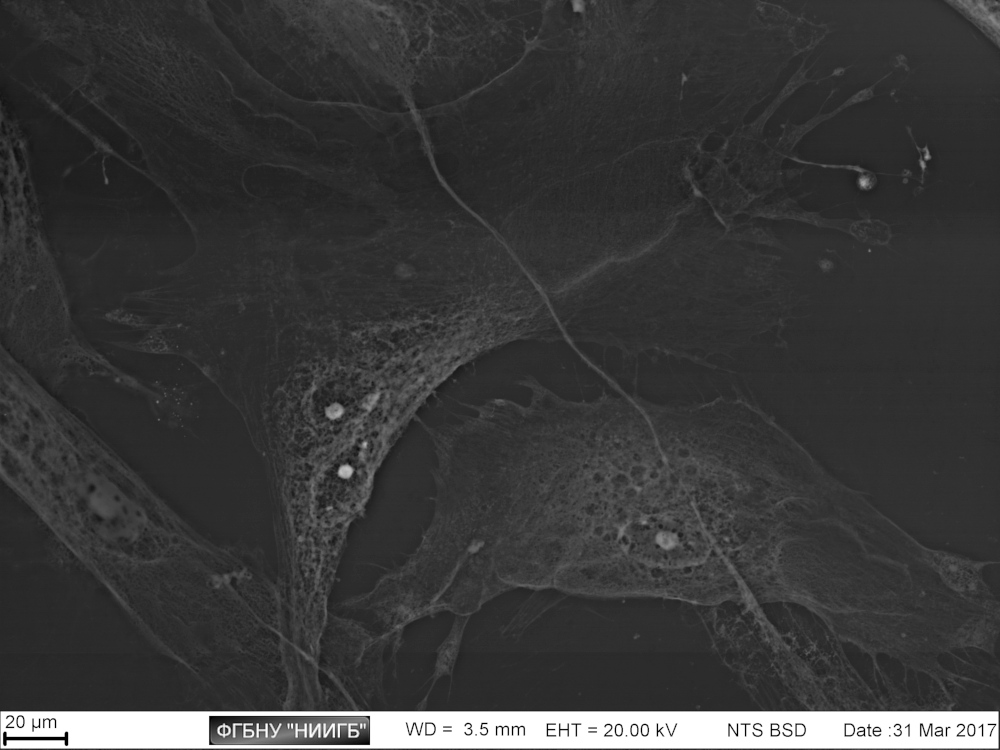
НаверхРезультаты применения (галерея)
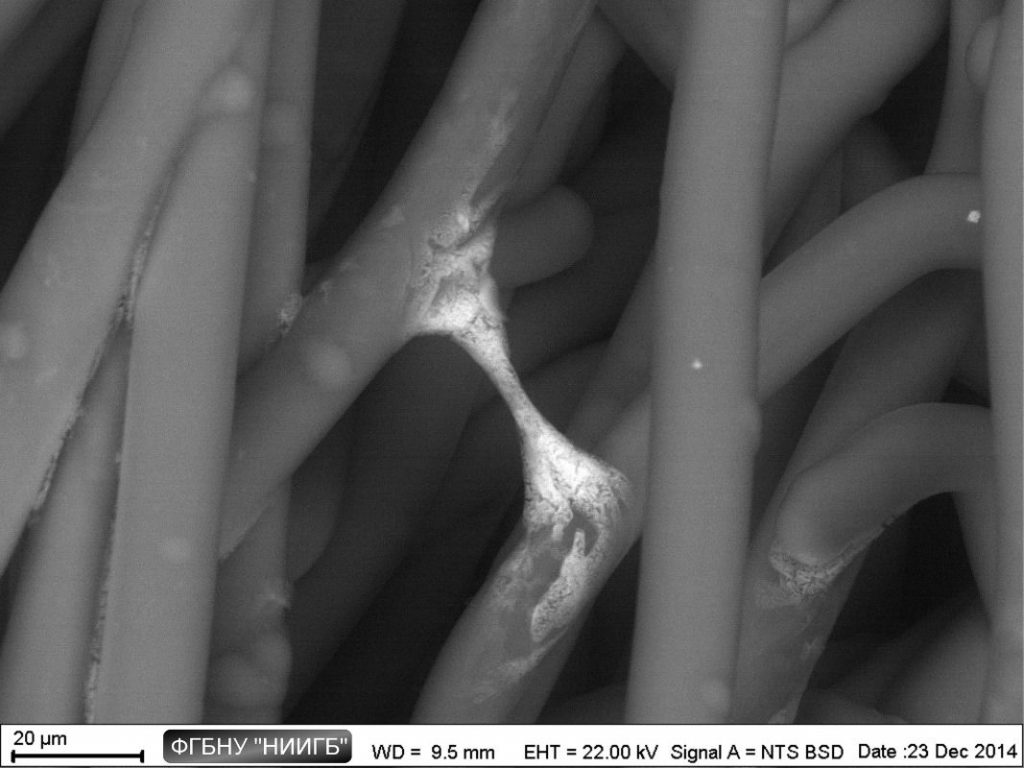
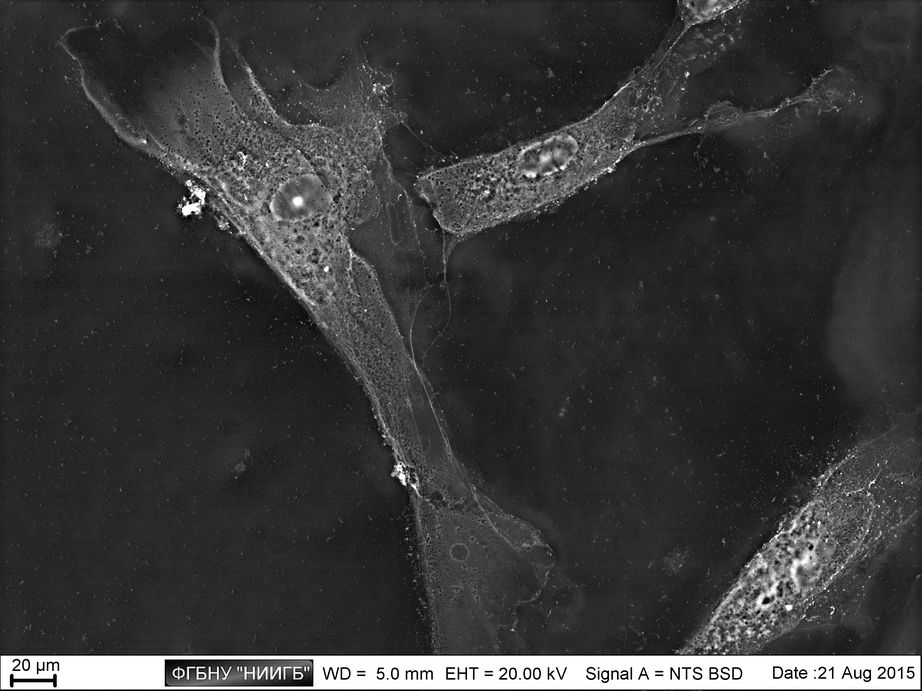
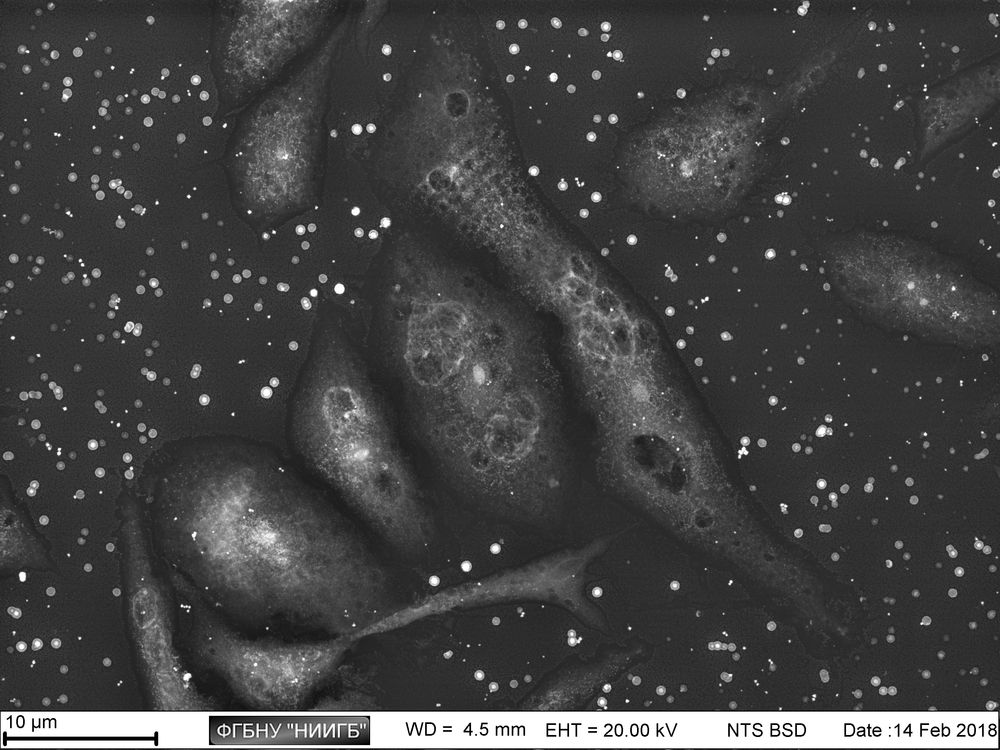
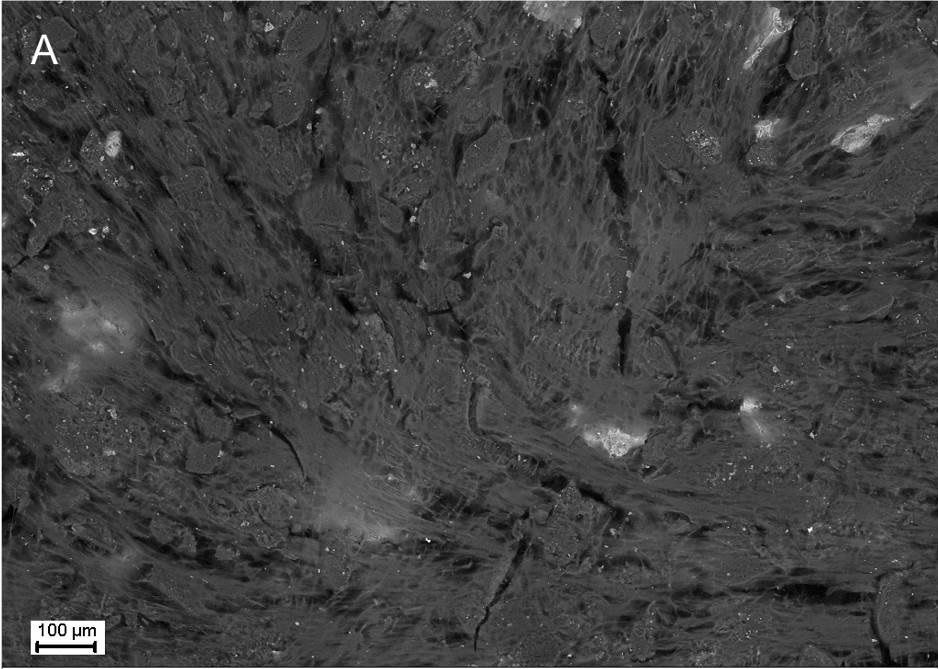
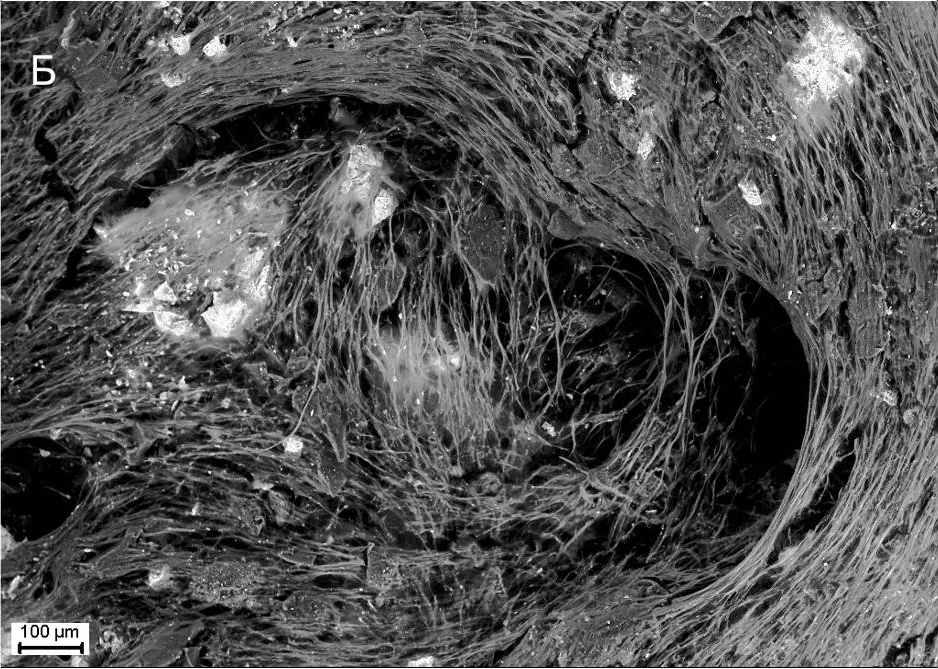
НаверхПриведенные образцы результатов исследований получены на электронном микроскопе Zeiss EVO LS10 в Лаборатории фундаментальных исследований ФГБНУ «НИИГБ».
Протокол использования
В зависимости от типа исследуемого образца процесс контрастирования с использованием набора «BioREE-A» может занимать от 30 мин до 1,5 ч. Высокая информативность контрастирования обеспечивается только при использовании в качестве исследуемого объекта живых (нефиксированных) клеток.
Подготовка образцов биологического материала:
Допустимо размещение исследуемых объектов (тонких тканевых проб толщиной до 1 мм, культивируемых или первично полученных клеток и др.) на пластике любого типа, силикатном стекле, в том числе с покрытием, а также на углеродных и полимерных скаффолдах на нефосфатной основе.
Последовательность проведения анализа:
- Первичная промывка образца изотоническим раствором хлорида натрия (необходима для удаления сорбировавшихся на поверхности образца компонентов ростовых сред и жидкостей основного вещества ткани, содержащих фосфат-ионы, и предотвращения нежелательного связывания с ними тропных к фосфатам контрастирующих ионов лантаноида).
- Помещение образца в водный изотонический раствор хлорида неодима (или др. Ln3+), экспозиция – от 15 до 45 мин. в зависимости от типа образца:
| Тип исследуемого образца | Экспозиция, мин |
| Прикрепленные клетки на подложках: | |
| Отдельные клетки на пластике или стекле с адгезивным покрытием | 15 |
| Монослой клеток на пластике или стекле с адгезивным покрытием | 30 |
| Тканеинженерная конструкция, 3D скаффолд | 30 |
| Нативная ткань | 45 |
| Суспензионные клетки: | |
| Суспензия клеток | 15 |
| Клетки, осажденные на мембрану | 15 |
| Бактерии, простейшие, дрожжи и т.п | 15 |
Прим.: для получения лучшего результата следует проводить контрастирование в условиях, максимально приближенным к физиологическим для данного клеточного типа.
3. Финальная промывка образца в дистиллированной воде (для удаления остатков контрастирующего реагента) в течение 1–10 сек.
После осуществления контрастирования с поверхности образца удаляют избыток воды, затем размещают его на предметном столике микроскопа и проводят сканирующюю электронную микроскопию в режиме низкого вакуума при ускоряющем напряжении 15–30 кВ при использовании детектора обратно-рассеянных электронов (BSE).
Особенности работы с суспензиями клеток:
Перед проведением контрастирования суспензию клеток следует осадить центрифугированием (200–1000g для животных клеток и 5000–15000g для бактериальных) и убрать супернатант. После добавления первого промывочного раствора образец встряхивают при помощи вортекса или перемешивают пипетированием, вновь центрифугируют и оставляют ресуспендированным в 1 мл супернатанта, убирая излишек.
После экспонирования образца в растворе лантаноида клетки осаждают на мембрану шприцевого фильтра, промывают кассету мембранного фильтра дистиллированной водой и быстро извлекают мембрану с осажденными клетками из кассеты, размещая на предметном столике микроскопа.
Более подробную информацию о подготовке образцов, проведении анализа и визуализации полученных препаратов на SEM можно получить, обратившись к следующим документам:
- Инструкция к набору «BioREE-A» (rus / eng)
- Протокол контрастирования (rus)
- Протокол визуализации контрастированных образцов на SEM (rus)
Механизм контрастирования
Лантоноидное контрастирование живых (нефиксированных) клеток осуществляется при использовании невысоких концентраций растворимых солей металлов этой группы (хлоридов лантана (LaCl3), неодима (NdCl3) и др.), воздействие которых не приводит к мгновенной гибели исследуемых клеток, а постепенно «выключает» в них энергозависимые процессы за счет протекания следующих реакций.
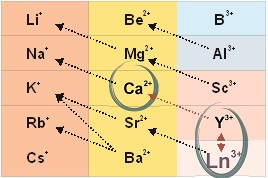
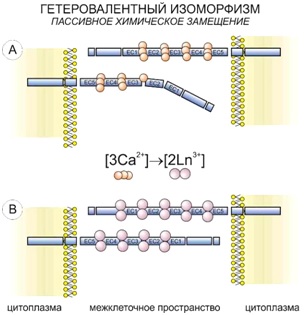
По принципу универсального химического изоморфизма, примененного в отношения живых систем, при обработке клетки ионами лантаноида в ее структурах происходит гетеровалентное замещение ионов кальция:
3Ca2+ ↔ 2La3+,
2Ca2+ ↔ La3+ + Me+.
Это позволяет повысить контрастность получаемого изображения методом SEM в режиме BSE более чем в 2 раза.
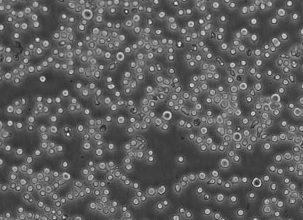
СЭМ-изображения в режиме BSE полилактогликолидного скаффолда, заселенного MMSC, через 2 дня после заселения
В основе такого повышения контрастности лежит не только более высокий атомный номер лантаноида по сравнению с кальцием, но и бóльшая эффективность связывания его в неорганических и металлоорганических соединениях.
Одной из мишеней в клетках, где наблюдается подобное гетеровалентное замещение, является кальциевые сочленения между пятичленными зонами белка кадгерина (компонента адгезивных контактов).
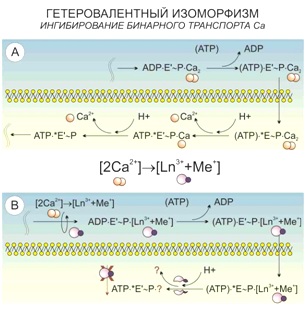
Также подобные реакции наблюдаются в участках клеточной мембраны, где располагаются кальциевые АТФазы и происходит одновременный транспорт двух ионов кальция. Данная система захватывает лантаноид в паре с щелочным металлом, и в точке деления этого канала на две ветви с независимым транспортом Ca2+ лантаноид уже не имеет возможности покинуть ее, оставаясь связанным с АТФ.
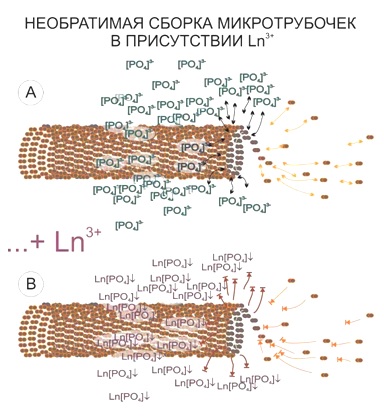
Другая мишень накопления лантаноида в клетке – зоны расположения элементов цитоскелета. Стоит отметить, что размер визуализируемых структур будет превышать реальный размер микротрубочек. Предполагается, что это – своеобразное «гало» связанных фосфат-анионов вокруг элементов цитоскелета, которые высвободились в процессе сборки микротрубочек, и, образуя нерастворимые соединения с ионами лантаноидов, ярко маркируют расположение микротрубочек и/или статистические направления их сборки.
Особенно контрастные СЭМ-изображения с препаратов, подготовленных набором «BioREE-A», можно получить при использовании детектора обратно-рассеянных электронов (BSE), в отличие от традиционно используемого при сканирующей электронной микроскопии детектора вторичных электронов (SE).
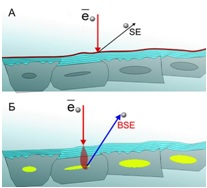
Таким образом, специфическое накопление лантаноидов в структурах клетки при подготовке препаратов с набором «BioREE-A» и исследовании методом SEM в режиме BSE обеспечивает визуализацию в клетке:
- ядрышек (за счет связывания лантаноидов с РНК),
- зон межклеточных контактов (за счет замещения лантаноидами кальция в белках типа кадгерина),
- расположения Ca-насосов (парный транспорт двух ионов кальция замещается трехвалентным ионом лантаноида в паре с щелочным металлом),
- следов сборки элементов цитоскелета (фосфатные остатки, образующиеся при протекании энергозатратных процессов, например, сборке микротрубочек, выпадают с лантаноидами в нерастворимые формы).
Список публикаций
- Суправитальное контрастирование лантаноидами для визуализации структуры биологических образцов на сканирующем электронном микроскопе / Новиков И.А., Суббот А.М., Федоров А.А., Грибоедова И.Г., Антонов Е.Н, Вахрушев И.В. // Гены и клетки 2015; Т. 10, №2, с. 90–96.
http://genescells.ru/article/supravitalnoe-kontrastirovanie-lantanoidami-dlya-vizualizatsii-strukturyi-biologicheskih-obraztsov-na-skaniruyushhem-elektronnom-mikroskope-2/ - Новый метод суправитального контрастирования биологических тканей на примере переднего эпителия роговицы для последующего исследования на сканирующем электронном микроскопе / Новиков И.А., Суббот А.М.,Федоров А.А., Грибоедова И.Г. // X Съезд офтальмологов России, Москва, 2015, с.194.
https://eyepress.ru/article.aspx?17462 - Разработка нового метода контрастирования биологических образцов для сканирующей электронной микроскопии / Новиков И.А., Фёдоров А.А., Грибоедова И.Г., Суббот А.М. // 19-я Международная Пущинская школа-конференция молодых ученых «Биология – наука XXI века», Пущино, 2015, с. 45.
http://download.biology21.ru/19_conference_biology21_full.pdf - Возможность оценки функционального состояния эпителия глазной поверхности in vitro методом СЭМ / Аветисов С.Э., Суббот А.М., Новиков И.А., Сафонова Т.Н., Федоров А.А. // VIII Российский общенациональный офтальмологический форум, Москва, 2015, с. 759–760.
Скачать PDF - Визуализация структуры эпителия роговицы методом сканирующей электронной микроскопии с лантаноидным контрастированием на основе Ca/Nd изоморфного замещения в Сa-зависимых молекулярных системах / Аветисов С.Э., Труфанов С.В., Новиков И.А., Суббот А.М., Федоров А.А. // Вестник офтальмологии 2016; Т. 132, № 6, с. 11–19.
DOI: 10.17116/oftalma2016132611-19
https://www.mediasphera.ru/issues/vestnik-oftalmologii/2016/6/10042465X2016061011/annotation - Визуализация мезенхимных cтромальных клеток в двумерных и трехмерных культурах методом сканирующей электронной микроскопии с лантаноидным контрастированием / Новиков И.А., Вахрушев И.В., Антонов Е.Н., Ярыгин К.Н., Суббот А.М. // Клеточные технологии в биологии и медицине 2016; №4, с. 248–253.
https://elibrary.ru/item.asp?id=28825547 - Fast and easy method of lanthanoid staining for visualization of cellular ultrastructure and spatial arrangement / Novikov I.A., Subbot A.M., Kiryushchenkova N.P., Nesterova T.V., Gabashvili A.N., Sitnikov A.V., Bursov A.I. // AIP Conference Proceedings 2016; Vol. 1748, Iss. 1, 020009.
DOI: 10.1063/1.4954343
https://aip.scitation.org/doi/10.1063/1.4954343 - Fast and easy method of lanthanoid staining for visualization of cellular ultrastructure and spatial arrangement / Novikov I.A., Subbot A.M., Kiryushchenkova N.P., Nesterova T.V., Gabashvili A.N., Sitnikov A.V., Bursov A.I. // V International Scientific Conference STRANN 2016, Saint Petersburg, 2016, p. 134–136.
https://www.researchgate.net/publication/315787308_Fast_And_Easy_Method_Of_Lanthanoid_Staining_For_Visualization_Of_Cellular_Ultrastructure_And_Spatial_Arrangement - Новая информативность для «старых приборов» – лантаноидное контрастирование биологических образцов для СЭМ / Суббот А.М., Новиков И.А., Нестерова Т.В., Чеботарь И.В. // III международная конференция молодых ученых, Новосибирск, 2016, с. 93–97.
https://openbio.ru/openbio_tezis_2016.pdf - Патент 2015117678/15, 12.05.2015. Способ подготовки биологического образца к исследованию при помощи сканирующей электронной микроскопии / Новиков И.А., Федоров А.А., Суббот А.М., Грибоедова И.Г. // Патент России № 2578977, 2016. Бюл. № 9.
http://www1.fips.ru/fips_servl/fips_servlet?DB=RUPAT&DocNumber=2578977&TypeFile=html - Лантаноидное контрастирование как ускоренная технология пробоподготовки микробиологических препаратов для сканирующей электронной микроскопии / Чеботарь И.В., Новиков И.А., Суббот А.М., Маянский Н.А. // Современные технологии в медицине 2017; Т. 9, № 3, с. 23–30.
DOI: 10.17691/stm2017.9.3.03
http://www.stm-journal.ru/ru/numbers/2017/3/1363 - Visualization of mesenchymal stromal cells in 2d and 3d-cultures by scanning electron microscopy with lanthanide contrasting / Novikov I.A., Subbot A.M., Vakhrushev I.V., Yarygin K.N., Antonov E.N. // Bull Exp Biol Med 2017; Т. 162, № 4, с. 558–562.
DOI: 10.1007/s10517-017-3659-4
https://link.springer.com/article/10.1007%2Fs10517-017-3659-4 - Новый взгляд на ультраструктуру комплекса клеточной адгезии эпителия роговицы / Новиков И.А., Суббот А.М., Труфанов С.В., Текеева Л.Ю. // Точка зрения. Восток – Запад 2017; № 1, с. 64–66.
https://eyepress.ru/article.aspx?23877 - Разработка нового метода контрастирования биологических образцов для сканирующей электронной микроскопии / Суббот А.М, Фёдоров А.А., Грибоедова И.Г. // Всероссийская молодёжная конференция «Экспериментальная и теоретическая биофизика’17», Пущино, 2017, с. 13–14.
Скачать PDF